WSTĘP
Endometrioza jest powszechnie spotykaną, zależną od estrogenów chorobą zapalną, która dotyka od ok 6-10% kobiet w wieku rozrodczym i jest definiowana jako schorzenie rozrostowe charakteryzujące się obecnością błony śluzowej macicy (endometrium) poza miejscem jej fizjologicznego występowania – czyli na zewnątrz jamy macicy.
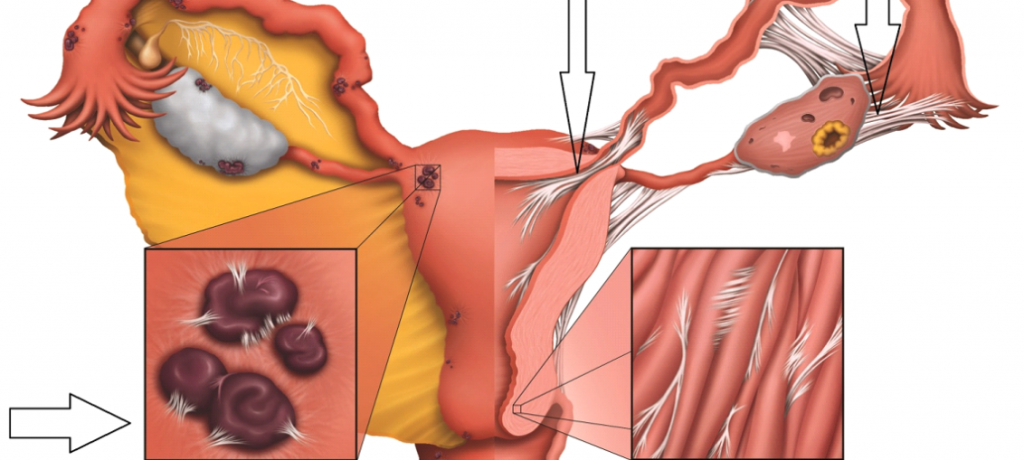
Tkanki te, zbliżone do struktur błony śluzowej macicy często nazywane są „implantami”, bo w sumie trochę je przypominają (patrz poniższe zdjęcie) i w przebiegu endometriozy mogą być rozsiane dosłownie wszędzie – najczęściej w jajowodach i jajnikach, ale dość często też w jamie otrzewnej, a czasami nawet w płucach, w mózgu, na pęcherzu, w bliźnie np. po cesarskim cięciu, w błonie śluzowej nosa itd. Tak samo jak endometrium w macicy tak samo jak i poza nią w przebiegu endometriozy tkanki te posiadają receptory dla estrogenów, progesteronu czy testosteronu – a więc reagują na zmiany w ich stężeniach i wiążą się z różnymi objawami z tym związanymi.
STATYSTYKI
Uważa się, że endometrioza dotyczy około 6-10% kobiet w wieku rozrodczym i do 50% kobiet borykających się z niepłodnością oraz bólami w okolicach miednicy, przy czym szczyt występowania tego schorzenia występuje między 25 a 35 rokiem życia.
W Polsce jednak statystyki nie są precyzyjnie opracowane z następujących głównych powodów:
- Często niemego i bezobjawowego przebiegu;
- Mało specyficznych objawów;
- Lekceważenie objawów zarówno przez kobiety jak i przez lekarzy – branie ich za fizjologiczne i normalne, ala „taka Twoja/Moja uroda”, „jak urodzisz to Ci/Mi przejdzie”;
- Szerokie stosowanie antykoncepcji od dość młodych lat co może maskować objawy choroby;
- Empiryczne leczenie bóli menstruacyjnych;
- Postawienie końcowej diagnozy wymaga wykonania laparoskopii na co niechętnie idzie zarówno wiele lekarzy jak i pacjentek ze względu na inwazyjność badania;
- Często jest mylona z PID (zapalenie miednicy mniejszej), torbielami jajników lub zespółem jelita drażliwego (IBS);
- Kobiety najczęściej zaczynają szukać pomocy dopiero wtedy, kiedy planują dziecko i nie mogą zajść w ciąże dłużej niż przez rok czasu starań;
- Trudności i bardzo duże opóźnienia w diagnostyce – średnio może upływać nawet 10 lat od wystąpienia pierwszych objawów do postawienia diagnozy
PRZYCZYNOWOŚĆ?
Niejednorodność zmian, przebieg choroby i różne objawy rodzą ważne pytania dotyczące tego, czy endometrioza jest jedną chorobą, czy też różnymi podtypami o różnych przyczynach. Spośród wielu proponowanych teorii przyczynowości tej choroby żadna z nich do tej pory nie wyjaśnia w 100% wszystkich rodzajów endometriozy.

Wiemy na pewno, że występuję bardzo mocny czynnik genetyczny – endometrioza występuje 10-krotnie częściej, jeśli występuję w rodzinie pierwszym stopniu pokrewieństwa, np. u mamy. Nieprawidłowości genetyczne i nakładanie się na nie czynników środowiskowych mogą przyczyniać się do poniższych mechanizmów.
1.Teoria mechanicznego przemieszczenia się fragmentów błony śluzowej macicy w trakcie miesiączki wstecznie przez jajowody do jamy otrzewnowej, które tam się zatrzymują, rozmnażają, tworząc ogniska endometriozy – zjawisko tzw. „wstecznej miesiączki” zaproponowane przez Sampsona jeszcze w 1927 roku.
Jednak taki mechanizm występuje u 90% miesiączkujących kobiet – analiza płynu otrzewnowego często zawiera krew, a także komórki błony śluzowej macicy w okresie okołomiesiączkowym. Skoro taki mechanizm występuje u 90% kobiet miesiączkujących to, dlaczego ktoś zapada na endometrioze (mniejszość), a większość jednak nie? Przytacza się tu teoria tego, że u kobiet chorujących występują po prostu genetyczne, immunologiczne i/lub biochemiczne różnice, które przyczyniają się do rozwoju endometriozy na skutek powyżej wspomnianego mechanizmu.
Pomimo wielu dowodów przemawiających za tą teorią, przypadki endometriozy u dziewcząt jeszcze nie miesiączkujących, noworodków czy nawet mężczyzn wymagają wtórnych wyjaśnień.
Dodatkowo teoria „wstecznej miesiączki” nie wyjaśnia, dlaczego czasami zmiany pojawiają się w tak oddalonych częściach ciała jak np. mózgu, na pęcherzyku żółciowym, nerce, śledzionie, płucach, błonie śluzowej nosa, żołądku itd.
2. Powyższe przypadki tłumaczy się kolejnym zjawiskiem – metaplazji komórek wyściółki otrzewnej.
Teoria metaplazji postuluje, że endometrioza powstaje z metaplazji komórek wyściełających otrzewną pod wpływem różnych bodźców hormonalnych, środowiskowych lub zakaźnych. Metaplazja mówiąc językiem ludzkim oznacza przemianę jednego rodzaju komórek w drugie odmiennie czynnościowo i morfologicznie. To zjawisko jednak powstaje znowuż z niewyjaśnionych do końca przyczyn.
3. Podejrzewa się też, że rozprzestrzenianie się/rozsiewanie komórek macierzystych z endometrium poza jamę miednicy co może odbywać się za pośrednictwem płynu limfatycznego lub struktur naczyniowych, aby następnie przekształcić w zmiany endometriotyczne w miejscu swojego „osiedlenia”;
4. Fizjologiczna przyczyna.
Przeniesienie komórek endometrium poza miejsce jej naturalnego „pobytu” czyli poza jamę macicy może nastąpić na skutek cięcia cesarskiego, w przypadku wykonywania laparoskopii czy też po nacięciu krocza. W takim przypadku endometrioza rozwija się w bliznach.
5. Zaburzenia odporności a endometrioza.
Po przemieszczeniu tkanek endometrium do innych części ciała muszą one zmierzyć się z „wojskiem” jakim jest układ immunologiczny.

Prawidłowo pracujący układ odpornościowy ma być w stanie sprzątnąć komórki i zapobiec implantacji. Jednak okazuje się, że komórki endometrium u kobiet z endometriozą są bardziej odporne na atak immunologiczny, mają zwiększoną zdolność do namnażania się i zwiększoną aktywność enzymu aromatazy, co prowadzi do zwiększonego stężenia estradiolu co nasila zmiany endometrialne w miejscu ich implantacji. Jest to czynnik znowuż genetyczny – różne polimorfizmy genów biorących udział w procesach detoksykacji od hormonów, wrażliwości receptorów estrogenowych, cytokiny, białka immunomodulujące (np. receptory Toll-podobne) zostały zbadane i potwierdzone u kobiet z endometriozą.
6. Kaskada zdarzeń obejmująca odpowiedź zapalną jest ważnym aspektem rozwoju endometriozy.
Cytokiny są głównymi mediatorami i komunikatorami układ odpornościowego – komórki immunologiczne wykorzystują cytokiny do koordynowania odpowiedzi organizmu na różne infekcję, urazy, albo poprzez autokrynną i parakrynną sygnalizację. Cytokiny tworzą niezwykle skomplikowany, wybiórczo działający na nasz układ immunologiczny system, mają różnorakie działanie i dzielą się na różne podgrupy.
Ze względu na ich rolę w regulacji odpowiedzi immunologicznej cytokiny są ogólnie klasyfikowane jako pro lub przeciwzapalne. Cytokiny prozapalne, takie jak np. interleukina-1 (IL-1), czynnik martwicy nowotworów alfa (TNF-?) czy interferon gamma (IFN-?) przede wszystkim inicjują i wzmacniają odpowiedź zapalną. Cytokiny przeciwzapalne, takie jak IL-4, IL-6 i IL-10, przede wszystkim regulują intensywność i czas trwania odpowiedzi zapalnej poprzez tłumienie działania cytokin prozapalnych, chociaż niektóre z nich też jednocześnie pełnią również role zapalną.
Normalna odpowiedź immunologiczna pociąga za sobą równowagę zapalnych i przeciwzapalnych cytokin. W endometriozie natomiast obserwuje się rozregulowanie tej równowagi oraz zauważalne zakłócenia aktywności immunologicznej, co jest uznawane za ważny aspekt patogenezy tej choroby jak i wielu innych schorzeń. Nieprawidłowe zachowanie komórek odpornościowych obserwowane u kobiet z endometriozą pomagają w implantacji i przetrwaniu zmian endometriotycznych poprzez zwiększenie regulacji szlaków zapalnych.
Dlatego mówi się, że endometrioza jest zależną od estrogenów chorobą zapalną. Dlaczego zależną od estrogenów – patrz następny punkt.
7. Czynnik hormonalny
W normalnych warunkach fizjologicznych endometrium w macicy podlega cyklicznej regulacji przez zmieniający się poziom estrogenów i progesteronu w przebiegu cyklu menstruacyjnego, a powierzchowna, funkcjonalna warstwa endometrium ulega proliferacji, różnicowaniu i złuszczaniu się w trakcie miesiączki, jeśli nie dochodzi do zapłodnienia.
Jednak komponenty zmian endometriotycznych reagują w inny sposób na hormony steroidowe pęcherzyków jajnikowych. Estradiol (E2), jest biologicznie aktywną formą estrogenu, który odgrywa kluczową rolę w odbudowie endometrium po miesiączce. E2 powstaje głównie z jajników, ale także np. w tkance tłuszczowej czy obowodowo na skutek konwersji (przemianach) z innych hormonów.
Aromataza P450 jest enzymem, który konwertuje androstendion w estron, natomiast dehydrogenaza 17?-hydroksysteroidowa typu 1 (17?-HSDT1) zajmuje się konwersją estronu do estradiolu. W endometrium zdrowych kobiet (bez endometriozy) aktywność aromatazy jest niewykrywalna – jednak zarówno endometrium, jak i „implanty” endometriotyczne u kobiet z endometriozą wykazują ekspresję tego enzymu w znacznie dużych ilościach, umożliwiając miejscową produkcję E2. Co to w praktyce oznacza? Zdolność „implantu” do własnego wytwarzania E2 i enzymów niezbędnych do jej wytworzenia, ułatwia implantację fragmentów endometrium w różnych częściach organizmu.
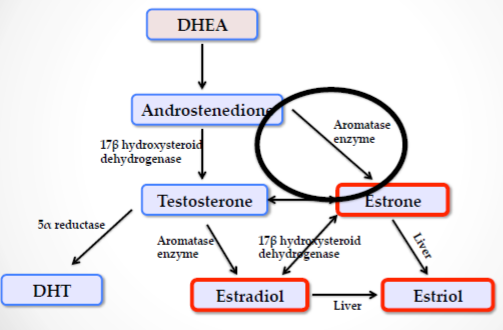
Oprócz zwiększonego miejscowego wytwarzania E2 zarówno w endometrium, jak i ektopowych zmianach endometriotycznych u kobiet z endometriozą, oporność na progesteron przyczynia się do patogenezy endometriozy. Progesteron, który jest wytwarzany głównie podczas fazy lutealnej przez ciałko żółte ma za zadanie działać przeciwstawnie do estradiolu i hamować jego dalsze działanie proliferancyjne. Progesteron też powoduje, że endometrium zaczynają się różnicować. Podobnie jak estrogen, progesteron oddziałuje z dwoma rodzajami receptorów, PR-A i PR-B, z których każdy ma inne funkcje. W zmianach endometrialnych nie receptorów PR-B, a receptor PR-A jest ledwo wyrażony – jest to dowód na to, że oporność na progesteron w endometriozie może leżeć na poziomie molekularnym.
Taka oporność na własny progesteron czy też na leczenie farmakologiczne syntetycznym progesteronem powoduje zwiększone miejscowe stężenie E2 oraz dalsze promowanie wzrostu zmian endometriotycznych ze względu na niezdolność progesteronu do aktywacji ezymu dehydrogenazy 17?-hydroksysteroidowej typu 2 (17?-HSDT2), którego zadaniem jest dezaktywować proliferancyjny E2 do słabszego biologicznie estronu (E1).
8. Po raz pierwszy w endometriozie zaproponowano nową koncepcję zwaną „hipotezą zanieczyszczenia bakteryjnego”[7]
Zbadano rolę endotoksyny bakteryjnej (lipopolisacharyd, LPS) i receptora Toll-podobnego 4 (TLR4) w endometriozie.
W badaniu, które zaproponowało tą nową koncepcję zbadano poziomy endotoksyny LPS w krwi menstruacyjnej i płynie otrzewnowym i zbadano jej potencjalną rolę we wzroście endometriozy. Próbki krwi menstruacyjnej i endometrium hodowano pod kątem obecności drobnoustrojów. Badano też wpływ leczenia agonistą hormonu uwalniającego gonadotropinę (GnRHa) na wewnątrzmaciczną kolonizację drobnoustrojów i występowanie zapalenia błony śluzowej macicy.
U kobiet z endometriozą krew menstruacyjna była silnie zanieczyszczona Escherichea coli oraz stwierdzono, że stężenie endotoksyny (LPS) było 4 do 6 krotnie lub znacznie wyższe u kobiet z endometriozą niż u kobiet bez endometriozy. Wzrost drobnoustrojów bakterii ochronnych wytwarzających kwas mlekowy (Lactobacillus spp.) był zmniejszony w próbkach endometrium pochodzących od kobiet z endometriozą i po leczeniu GnRHa.
E.Coli to bakteria, która normalnie się znajduje się w składzie fizjologicznej flory bakteryjnej jelita grubego i spełnia bardzo ważną rolę jak np. bierze udział w produkcji witamin z grupy B czy witaminy K. Mimo że jest mile widziana w jelicie grubym to w pochwie czy też innych częściach ciała już może się stać problemem – w pochwie np. wywołuje stan zapalny, bo komórki odpornościowe mogą być aktywowane przez składniki drobnoustrojów takie jak np. lipopolisacharyd (LPS) z bakterii Gram-ujemnych. Resztkowe nagromadzenie bakteryjnej endotoksyny LPS w środowisku miednicy można wytłumaczyć dwoma możliwymi mechanizmami:
1. translokacja E. coli lub endotoksyny LPS z jelit przez enterocyty i ich wejście do jamy miednicy;
2. zakażenie E.Coli, co staje się stałym źródłem endotoksyny bakteryjnej LPS.
Skąd E.Coli się może pojawić w pochwie? No np. na skutek transmisji z cewki moczowej i dolnego odcinka przewodu pokarmowego, a potem lubi się namnażać wtedy, kiedy występuje ilościowe i jakościowe zaburzenia naturalnej mikroflory pochwy. Lipopolisacharyd (LPS) natomiast jest składnikiem budulcowym bakterii Gram-ujemnych. Pałeczka okrężnicy (Escherichia coli) właśnie jest bakterią gram ujemną. W czasie zakażenia LPS staje się czynnikiem, który wywołuje reakcję zapalną organizmu. Aktywowany przez LPS receptor TLR4 uruchamia kaskadę prozapalną w miednicy i i może promować wzrost i postęp endometriozy.
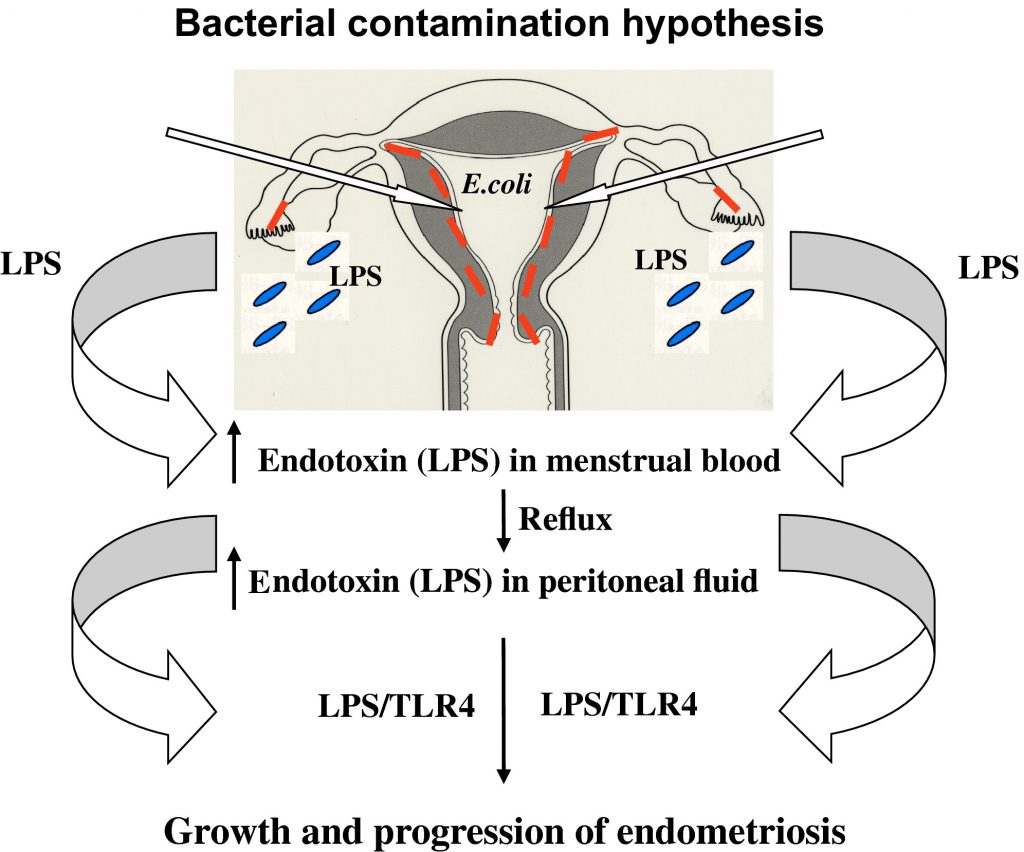
Jest to ważny mechanizm, gdyż jak już wiemy z powyższych informacji literatura naukowa wykazuje, że oprócz czynników hormonalnych, zarówno cytokiny, czynniki wzrostu czy mediatory zapalne są zaangażowane we wzrost endometriozy. Jako mediator zapalny, LPS może być początkowym czynnikiem wyzwalającym, a jego bakteryjne źródło w środowisku wewnątrzmacicznym, może być główną przyczyną regulacji wzrostu endometriozy, samodzielnie lub w połączeniu z wyżej omawianymi czynnikami.
PODSUMOWANIE
Endometrioza jest chorobą wieloczynnikową, i jak widać dokładna czy też jedyna patogeneza tej choroby jest nadal nieznana i powstaje bardzo dużo teorii, każda z których ma swoje naukowe uzasadnienie.
Obecne dowody wskazują, że czynniki genetyczne, hormonalne i immunologiczne są najmocniej zaangażowane w patogenezę endometriozy – jednak nadal nie jest jasne co jest przyczyną rozwoju endometriozy a co skutkiem.
Wiemy na pewno, że nieprawidłowe zachowanie komórek odpornościowych obserwowane u kobiet z endometriozą pomagają w implantacji i przetrwaniu zmian endometriotycznych. Ale czy rozregulowanie cytokin jest jednym z czynników wywołujących rozwój endometriozy, czy też powstaje po rozwinięciu się endometriozy poprzez inne mechanizmy? Może po prostu te nieprawidłowe odpowiedzi immunologiczne są zaostrzone przez „unikalne” środowisko hormonalne, w którym się rozwijają? Mimo wszystko, istnieją od dłuższego czasu już debaty na temat tego, czy klasyfikować endometriozę jako stan zapalny czy zaburzenie autoimmunologiczne.
Wiadomo na pewno, że potrzebne są dalsze badania nie tylko w celu lepszego zrozumienia tego stanu, ale także w celu ulepszenia naszych obecnych podejść do leczenia zarówno ze strony lekarzy, jak i wspomagania leczenia ze strony dietetyków oraz innych specjalistów w branży prozdrowotnej.
W drugiej części artykułu poruszymy objawy – manifestacja kliniczna, rozpoznanie endometriozy, leczenie ze strony medycyny klinicznej/lekarzy oraz wspomaganie leczenia ze strony stylu życia, żywienia czy suplementacji.
*Artykuł ma charakter informacyjny, wszystkie dolegliwości oraz wyniki badań warto konsultować z lekarzem.
BIBLIOGRAFIA:
- Prof. CMPK dr hab. n. med. Romuald Dębski: “Endokrynologia ginekologiczna. Najczęstsze problemy”. PZWL 2018/2, str.11-22;
- Grant W. Montgomery, Ph.D., and Linda C. Giudice, M.D., Ph.D.: New Lessons about Endometriosis — Somatic Mutations and Disease Heterogeneity.N Engl J Med 2017; 376:1881-1882;
- Paolo Vercellini, et.al.: Endometriosis: pathogenesis and treatment.Nature Reviews Endocrinology volume 10, pages 261–275 (2014);
- Neil P Johnson, et.al.: World Endometriosis Society consensus on the classification of endometriosis. Human Reproduction, Volume 32, Issue 2, 1 February 2017, Pages 315–324;
- Vicki Nisenblat, et.al.: Blood biomarkers for the non‐invasive diagnosis of endometriosis. Cochrane Database of Systematic Reviews 2016;
- Soo Hyun Ahn, et.al.: Pathophysiology and Immune Dysfunction in Endometriosis. Hindawi Publishing Corporation, BioMed Research International, Volume 2015, Article ID 795976;
- Khaleque N. Khan, et.al.: Bacterial contamination hypothesis: a new concept in endometriosis. Reproductive Medicine and Biology. Volume17, Issue2, April 2018.